华海药业冲击10亿美元品种 抗痛风药可在美销售
4月1日,华海药业公告称,公司向FDA申报的左乙拉西坦注射液、非布司他片的ANDA已获得批准,截至公告日,华海药业在上述两款产品已投入研发费用分别约598万元、1430万元。米内网数据显示,今年以来,华海药业获得FDA批准的ANDA已达5个。
左乙拉西坦注射液是由UCB研发的一款抗癫痫药,最早于2006年在美国上市,2021年优时比的左乙拉西坦全球销售额达9.7亿欧元(以4月1日汇率计,约10.7亿美元)。目前在美国境内,左乙拉西坦注射液的主要生产厂商包括Viatris、Aurobindo、Hikma等。
而在国内市场,华海药业于2020年11月以仿制4类提交左乙拉西坦注射用浓溶液上市申请,近日已步入行政审批阶段,有望于近期获批。
非布司他片是由Tekeda研发的一款黄嘌呤氧化酶抑制剂,主要用于痛风患者高尿酸血症的长期治疗。原研产品最早于2009年3月在美国上市,目前在美国境内,非布司他片的主要生产厂商有Viatris、Sun、Alembic等。
华海药业的非布司他片ANDA于2018年5月获得FDA暂时批准,此次为正式获得批准。而在国内市场,华海药业曾于2014年提交非布司他片上市申请,之后主动撤回,目前还处于开展BE试验阶段。
华海药业表示,左乙拉西坦注射液ANDA文号的获批及非布司他片获得正式批准,标志着公司具备了在美国市场销售上述产品的资格,这有利于公司不断扩大美国市场销售,强化产品供应链,丰富产品梯队,提升公司产品的市场竞争力,对公司的经营业绩产生积极的影响。
2022年至今华海药业获批的ANDA
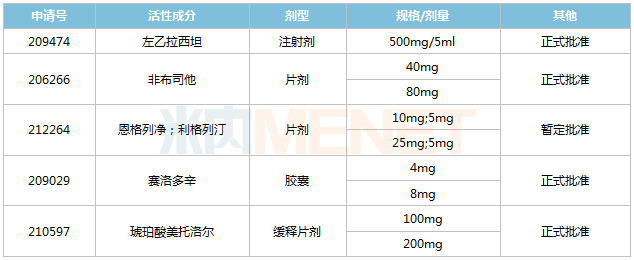
来源:米内网全球上市药物库
米内网数据显示,含左乙拉西坦、非布司他在内,今年以来华海药业已有5个ANDA获得FDA批准,其中恩格列净利格列汀为暂定批准。
来源:米内网数据库、上市公司公告等
注:数据统计截至4月1日,如有疏漏,欢迎指正!
【版权声明】秉承互联网开放、包容的精神,开云电竞入口 欢迎各方(自)媒体、机构转载、引用我们原创内容,但要严格注明来源开云电竞入口 ;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,烦请将版权疑问、授权证明、版权证明、联系方式等,发邮件至pharmnet@netsun.com,我们将第一时间核实、处理。
- 相关报道
-
- HB002.1M药物上市可期 华海药业发力百亿眼科疾病药物市场(2021-11-12)
- 华海药业:普瑞巴林胶囊获得药品注册证书 直击国内内服TOP1止痛药市场(2021-10-26)
- 华海药业:注重研发投入 加快生物药和创新药领域布局(2021-10-20)
- TIGIT单抗获批临床 华海药业生物药管线稳步推进(2021-08-04)
- 华海药业两款产品获批 将惠及国内高血压、心脑血管疾病患者(2021-04-30)
- 华海药业PD-L1/VEGF在美完成首例患者给药(2021-03-15)
- 国家医保目录再升级 华海药业两个品类入围(2020-12-29)
- 华海药业举办首届“科技节”(2020-12-07)
- 关爱抑郁症人群 华海药业持续加码抗抑郁药物研发(2020-12-01)
- 华海药业前三季度业绩大涨 销售费用正在减少(2020-10-22)



